Blei(II)-nitrat
Heutzutage ist Blei(II)-nitrat ein Thema, das die Aufmerksamkeit vieler Menschen auf sich gezogen hat. Von seinen Auswirkungen auf die Gesellschaft bis hin zu seiner Relevanz im beruflichen Bereich ist Blei(II)-nitrat zu einem immer häufigeren Gesprächsthema geworden. Mit dem Fortschritt der Technologie und der Globalisierung hat Blei(II)-nitrat eine beispiellose Bedeutung in unserem Leben erlangt. In diesem Artikel werden wir die verschiedenen Facetten von Blei(II)-nitrat untersuchen und seinen Einfluss auf verschiedene Aspekte unserer Realität analysieren. Von seiner Geschichte bis zu seinen zukünftigen Auswirkungen ist Blei(II)-nitrat ein Thema, das eine genaue Untersuchung verdient.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
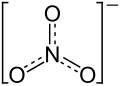
| |||||||||||||||||||
| Kristallsystem |
kubisch | ||||||||||||||||||
| Raumgruppe |
Pa3 (Nr. 205) (früher Raumgruppe Pa3)[1] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Blei(II)-nitrat | ||||||||||||||||||
| Andere Namen |
Bleinitrat | ||||||||||||||||||
| Summenformel | Pb(NO3)2 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 331,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,53 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[6] | ||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Blei(II)-nitrat, ein weißer, kristalliner Feststoff, ist das Blei(II)-salz der Salpetersäure. Blei(II)-nitrat ist ein starkes Oxidationsmittel. Es ist im Gegensatz zu anderen Bleisalzen gut in Wasser löslich. Aus diesem Grund ist es giftig.
Darstellung

Blei(II)-nitrat entsteht bei der Reaktion von heißer, verdünnter Salpetersäure mit (1) Blei[7] oder (2) Blei(II)-oxid:
Aus den Lösungen kristallisiert es in großen, wasserklaren Kristallen aus.
Die Umsetzung von Blei(II)-carbonat mit Salpetersäure liefert ebenso Blei(II)-nitrat unter Bildung von Kohlenstoffdioxid:
Eigenschaften

Im Gegensatz zu vielen anderen Blei(II)-salzen wie Blei(II)-chlorid oder Blei(II)-sulfat ist Blei(II)-nitrat gut in Wasser löslich.[4]
Erhitzt man Blei(II)-nitrat bis zu seiner Zersetzungstemperatur von 470 °C, so zerfällt es unter Bildung von Stickstoffdioxid, Sauerstoff und Blei(II)-oxid:[4]
Daher ist diese chemische Reaktion im Labor zur Bildung geringer Mengen des Gases Stickstoffdioxid geeignet.[8] Wegen der Sauerstoff-Freisetzung wird Blei(II)-nitrat bei der Synthese von Farbstoffen als Oxidationsmittel eingesetzt.[9]
Toxizität
Bleinitrat ist gesundheitsschädlich, fruchtschädigend und kann möglicherweise die Fortpflanzungsfähigkeit beeinträchtigen. Es kann, wenn auch nur in vernachlässigbarer Menge, durch die Haut aufgenommen werden. Außerdem geht von ihm eine Gefahr für die Umwelt aus, da es giftig für Wasserorganismen ist.[4]
Verwendung
Verwendung findet Blei(II)-nitrat weiterhin bei der Herstellung von Textilbeizen[10], Zündmischungen für Explosivstoffe[11], Ätzlösungen und zur Perlmuttfärbung.[9]
Einzelnachweise
- ↑ W. C. Hamilton: A Neutron Crystallographic Study of Lead Nitrate, in: Acta Cryst., 1957, 10, S. 103–107. doi:10.1107/S0365110X57000304.
- ↑ a b c d Datenblatt Blei(II)-nitrat bei Merck, abgerufen am 19. Januar 2011.
- ↑ Hermann P. T. Ammon: Hunnius Pharmazeutisches Wörterbuch. Walter de Gruyter & Co KG, 2021, ISBN 978-3-11-242212-0, S. 259.
- ↑ a b c d e Eintrag zu Blei(II)-nitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag lead compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 16. Juli 2014.
- ↑ Laboratory manual of chemistry, for secondary schools, 1905, S. 108.
- ↑ Karl A. Hofmann: Anorganische Chemie. Springer-Verlag, 2013, ISBN 978-3-663-14240-9, S. 137.
- ↑ a b RÖMPP Lexikon Chemie, 10. Auflage, 1996-1999: Band 1: A - Cl. Georg Thieme Verlag, 2014, ISBN 978-3-13-199951-1, S. 471.
- ↑ Heinrich Bechhold: Bechhold's handlexikon der naturwissenschaften und medizin. H. Bechhold, 1894, S. 873.
- ↑ Egon Wiberg: Anorganischen Chemie. Walter de Gruyter & Co KG, 2019, ISBN 978-3-11-144037-8, S. 348.







