P-Cymol
In der heutigen Welt ist P-Cymol zu einem Thema von großer Relevanz und Interesse für ein breites Spektrum der Gesellschaft geworden. Seit seiner Entstehung hat P-Cymol die Aufmerksamkeit von Wissenschaftlern, Experten, Fachleuten und der breiten Öffentlichkeit auf sich gezogen und intensive Debatten und endlose Diskussionen über seine Implikationen, Anwendungen und Konsequenzen ausgelöst. Ob aufgrund seiner Auswirkungen auf Technologie, Wirtschaft, Kultur oder Politik, P-Cymol ist weiterhin Gegenstand von Studien und Analysen, weckt wachsendes Interesse und zieht die Aufmerksamkeit verschiedener Akteure und Sektoren auf sich. In diesem Artikel werden wir die verschiedenen Facetten von P-Cymol, seine Herausforderungen, Chancen und möglichen Auswirkungen untersuchen, mit dem Ziel, seine Bedeutung zu beleuchten und zum Verständnis seines heutigen Umfangs und seiner Bedeutung beizutragen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
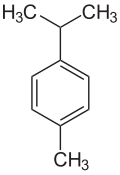
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | p-Cymol | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C10H14 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit aromatischem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 134,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
0,86 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
177 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (34 mg·l−1 bei 25 °C)[2] | |||||||||||||||
| Brechungsindex |
1,4907 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
p-Cymol (para-Cymol), auch als Dolcymen oder Camphogen bezeichnet, ist ein aromatischer Kohlenwasserstoff, genauer ein Alkylbenzol, und gehört zu den monocyclischen Monoterpenen. Es ist eine farblose, entzündliche Flüssigkeit mit charakteristischem Geruch. Zusammen mit seinen beiden Isomeren gehört es zur Gruppe der Cymole und ferner zu den C4-Benzolen.
Vorkommen und biologische Bedeutung
p-Cymol hat keine nachgewiesene biologische Aufgabe, dennoch kommt es in vielen Pflanzen wie Wermutkraut,[5] Sternanis,[6] Bay[7] verschiedenen Minzen (Mentha spicata, Mentha pulegium, Mentha arvensis var. piperascens),[8] Kampfer (Cinnamomum camphora),[8] Wacholder (Juniperus communis)[8] und Rosmarin vor. Die wichtigsten Pflanzen sind Koriander (Coriandrum sativum, bis zu 67300 ppm im Saatöl), Mexikanischer Drüsengänsefuß (Chenopodium ambrosioides, 730 bis 8000 ppm in der Pflanze), Boldo (Peumus boldus, 6000 bis 7500 ppm in den Blättern) und Sommer-Bohnenkraut (Satureja hortensis, 300 bis 6000 ppm in der Pflanze).[8]
-
Wermutkraut
-
Sternanis
-
Bay
-
Sommer-Bohnenkraut
-
Mexikanischer Drüsengänsefuß
Verwendung
p-Cymol ist ein gängiger Ligand für Rutheniumkomplexe. Die Ausgangsverbindung ist 2. Dieser Halbsandwichkomplex wird durch die Reaktion von Ruthenium(III)-chlorid mit dem Terpen α-Phellandren hergestellt. Der Osmium-Komplex ist auch bekannt.[9]
Sicherheitshinweise
Der Flammpunkt der Flüssigkeit liegt bei 47 °C[2], die Zündtemperatur bei 435 °C[2]. In Luftvolumenanteilen von 0,7 bis 5,6 % bildet es explosive Gemische.[2] Ein MAK-Wert ist für p-Cymol nicht festgelegt.[2]
Bei Inhalation führt p-Cymol zu Schwindel, Schläfrigkeit und Erbrechen. Die Haut entfettet es und rötet Haut und Augen. Bei Verschlucken führt die Flüssigkeit zu Durchfall, Kopfschmerzen, Übelkeit, Bewusstlosigkeit, Erbrechen und Schläfrigkeit.
Einzelnachweise
- ↑ Eintrag zu P-CYMENE in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- ↑ a b c d e f g h i j k l m n o p q Eintrag zu 4-Isopropyltoluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ R. T. O’Connor, L. A. Goldblatt: Correlation of Ultraviolet and Infrared Spectra of Terpene Hydrocarbons, in: Anal. Chem., 1954, 26, S. 1726–1737 (doi:10.1021/ac60095a014).
- ↑ Eintrag zu p-cymene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 8. Februar 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Otto Vostrowsky, Thorolf Brosche, Helmut Ihm, Robert Zintl, Karl Knobloch: Über die Komponenten des ätherischen Öls aus Artemisia absinthium L.. In: Zeitschrift für Naturforschung C. 36, 1981, S. 369–377 (PDF, freier Volltext).
- ↑ Jayanta Kumar Patra, Gitishree Das, Sankhadip Bose, Sabyasachi Banerjee, Chethala N. Vishnuprasad, Maria Pilar Rodriguez‐Torres, Han‐Seung Shin: Star anise (Illicium verum): Chemical compounds, antiviral properties, and clinical relevance. In: Phytotherapy Research. Band 34, Nr. 6, Juni 2020, S. 1248–1267, doi:10.1002/ptr.6614.
- ↑ J. Abaul, P. Bourgeois, J. M. Bessiere: Chemical composition of the essential oils of chemotypes ofPimenta racemosa var.racemosa (P. Miller) J. W. Moore (Bois d'Inde) of Guadeloupe (F.W.I.). In: Flavour and Fragrance Journal. Band 10, Nr. 5, September 1995, S. 319–321, doi:10.1002/ffj.2730100506.
- ↑ a b c d P-CYMOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 12. Juli 2021.
- ↑ M. A. Bennett, T.-N. Huang, T. W. Matheson, A. K. Smith, Steven Ittel, William Nickerson: (η6-Hexamethylbenzene)Ruthenium Complexes, in: Inorganic Syntheses, 1982, 21, S. 74–78 (doi:10.1002/9780470132524.ch16).








