Funktionelle Gruppe
In diesem Artikel tauchen wir in die faszinierende Welt von Funktionelle Gruppe ein und erforschen seine Ursprünge, Auswirkungen und Relevanz heute. Von seiner Entstehung bis zu seinem Einfluss in verschiedenen Bereichen der Gesellschaft hat Funktionelle Gruppe eine grundlegende Rolle bei der Gestaltung unserer Welt gespielt. Im Rahmen dieser detaillierten Analyse werden wir die wichtigsten Aspekte sowie die Kontroversen und Debatten untersuchen, die im Laufe der Zeit dazu geführt haben. Von seinem Einfluss auf die Populärkultur bis hin zu seinem Einfluss auf Politik und Wirtschaft hat sich Funktionelle Gruppe als Thema von unvermeidlichem Interesse im zeitgenössischen Diskurs positioniert. Begleiten Sie uns auf dieser Entdeckungs- und Reflexionsreise über Funktionelle Gruppe, um seine Bedeutung und seinen Stellenwert in unserer Gesellschaft besser zu verstehen.

In der Organischen Chemie versteht man unter einer funktionellen Gruppe (auch charakteristische Gruppe) ein Atom oder eine Atomgruppe, die bei jedem Auftreten auch in verschiedenen Verbindungen ähnliche Stoffeigenschaften und ein ähnliches Reaktionsverhalten zeigen. Die Moleküle werden gedanklich in ein relativ unreaktives Grundgerüst und eine oder mehrere funktionelle Gruppen unterteilt.[1] In diesem Zusammenhang wird von heterobifunktionalen Molekülen gesprochen (Beispiel: Ethanolamin) bzw. bei mehreren funktionellen Gruppen heteropolyfunktional (Beispiel: Tyrosin). Analog kann bei Molekülen mit mehreren gleichen funktionellen Gruppen von homobifunktional (Beispiel: Ethylenglycol) bzw. homopolyfunktional gesprochen werden (Beispiel: Glycerin).
Verbindungen, die gleiche funktionelle Gruppen, aber unterschiedliche Alkyl- oder Arylreste haben, werden auf Grund ihrer ähnlichen Eigenschaften zu Stoffklassen zusammengefasst.
Funktionelle Gruppen werden anhand der beteiligten Atome in funktionelle Gruppen mit Heteroatomen (meist O, N, S, P, Halogene) und solche ohne Heteroatome (z. B. C=C-Doppelbindungen, C≡C-Dreifachbindungen oder Aromaten) eingeteilt. Auch wenn Letztere manchmal nicht als „vollwertige“ funktionelle Gruppen, sondern nur als Strukturbausteine betrachtet werden, so zeigen sie doch ein besonderes und typisches Reaktionsverhalten, das die Bezeichnung funktionelle Gruppe und die jeweilige Zusammenfassung zu Stoffklassen rechtfertigt.
Im Fall von anorganischen oder metallorganischen Verbindungen werden auch einfache Alkyl- oder Arylgruppen als funktionelle Gruppen angesehen. Alle organischen Seitenketten und funktionellen Gruppen werden dann unter der allgemeinen Bezeichnung Organylgruppe zusammengefasst.
Für funktionelle Gruppen gibt es zur Vereinfachung der Schreibung in Strukturformeln und Texten Abkürzungen, die in der Liste der Abkürzungen in der organischen Chemie aufgelistet sind.
Eigenschaften
Nach der Definition beeinflusst eine funktionelle Gruppe die chemischen und physikalischen Eigenschaften der sie enthaltenden Ausgangsverbindung meist erheblich. Die Art der Beeinflussung wird am Beispiel des Alkans Butan und drei seiner strukturellen Abkömmlinge mit gleicher Anzahl von C-Atomen vor Augen geführt:
| Struktureller Abkömmling mit gleicher Anzahl von C-Atomen |
Verbindung | Halbstrukturformel | Eigenschaften |
|---|---|---|---|
| Ausgangsverbindung | Butan | H3C–CH2–CH2–CH3 | gasförmig |
| Carboxyverbindung | Butansäure, auch Buttersäure | H3C–CH2–CH2–COOH | flüssig, übelriechend, reagiert sauer |
| Aminoverbindung | Butan-2-amin, auch 2-Butylamin | H3C–CH(NH2)–CH2–CH3 | flüssig, übelriechend, reagiert basisch |
| Carboxy- und Aminoverbindung | 4-Aminobutansäure, auch 4-Aminobuttersäure oder γ-Aminobuttersäure (GABA) |
H2N–CH2–CH2–CH2–COOH | fest, liegt in wässriger Lösung als Zwitterion H3N+–CH2–CH2–CH2–COO− vor |
Formeln und Nomenklatur
Gemäß Vorgabe der IUPAC ist die substitutive Nomenklatur, die im Folgenden beschrieben wird, zur Benennung von Substanzen heranzuziehen. Nach dieser Nomenklatur ist die funktionelle Gruppe entweder als Vorsilbe (Präfix) oder als Endung (Suffix) im Namen der Gesamtverbindung anzugeben. Die Präfixe und Suffixe einiger funktionelle Gruppen werden aus sauerstoffhaltigen Gruppen abgeleitet, indem das O-Atom mit der funktionellen Ersetzungsnomenklatur verändert wird (z. B. -thiol aus -thio und -ol, das O-Atom wird durch Schwefel ersetzt). Für gewisse Gruppen wurde kein eigenes Präfix festgelegt, sondern es wird aus kleineren, darin enthaltenen Gruppen zusammengesetzt (z. B. bei Amiden, welche mit Präfix -oxo- und -amino- wie ein Keton und ein Amin behandelt werden).
Die IUPAC hat für die verschiedenen funktionellen Gruppen eine Rangfolge festgelegt. Die ranghöchste Gruppe wird dabei als Suffix verwendet und alle anderen, alphabetisch geordnet, als Präfixe. Die Ausnahme bilden Radikale und geladene Gruppen, die sogenannte kumulative Suffixe bilden. Die funktionellen Gruppen sind in der folgenden Tabelle nach abnehmender Priorität geordnet. Die Tabelle gibt nicht die vollständige Liste der IUPAC wieder.[2][3][4]
Siehe auch: Nomenklatur
Es gibt unterschiedliche Bezeichnungen, je nachdem ob das angegebene Kohlenstoffatom einen Teil des Stammsystems darstellt (Darstellung: R-CXYZ) oder nicht (Darstellung: R-CXYZ). Der zweite Fall erhält die höhere Priorität. Auf ggf. notwendige Klammerungen wurde verzichtet.
Verwendete Platzhalter:
- R für einen organischen Rest
- X für Halogenide
- Z für ein beliebiges Atom außer Wasserstoff H
- # für einen Lokanten, wo sinnvoll
| Halbstrukturformel | Strukturformel | Stoffklasse | Vorsilbe (Präfix) | Endung (Suffix) | Beispiele |
|---|---|---|---|---|---|
| Z• bzw. Z: Z•− Z•+ |
Radikale Radikalanionen Radikalkationen |
keine (früher Ylo-) |
-yl (Verlust eines H•) -yliden (Verlust zweier H•) u. a. m. |
(2,2,6,6-tetramethylpiperidin-1-yl)oxidanyl (TEMPO), Triplett-Carben | |
| Z− | Anionen | keine | -id (Verlust von H+) -uid (Addition von H−) Als Endung: -at, -it |
Ethin-1-id (Acetlyid) | |
| Z+ | Kationen | keine | -ylium (Verlust von H−) -ium (Addition von H+) (früher -onium) |
Methanaminium (Methylammonium), kationische Tenside | |
Säuren | |||||
| R–COOH R–COOH |
 |
Carbonsäuren | Carboxy- Carboxy- (Stammhydrid wird um ein C verkürzt) |
-carbonsäure -säure |
Butansäure (Buttersäure), Aminosäuren |
| R–COOOH R–COOOH |
Peroxycarbonsäuren | Carbonoperoxoyl- #-hydroperoxy-#-oxo- |
-carboperoxosäure -peroxosäure |
Ethanperoxosäure (Peroxyessigsäure) | |
| R–CS–OH R–CS–OH R–CO–SH R–CO–SH R–CS–SH R–CS–SH |
 |
Thiocarbonsäuren | Hydroxycarbonothioyl- -#-hydroxy-#-sulfanyliden- Sulfanylcarbonyl- -#-oxo-#-sulfanyl- Sulfanylcarbonothioyl- -#-sulfanyl-#-sulfanyliden- |
-carbothio-O-säure -thio-O-säure
|
|
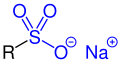
| R–SO2–OH |  |
Sulfonsäuren | Sulfo- | -sulfonsäure | z. B. Benzolsulfonsäure |
| R–SO–OH |  |
Sulfinsäuren | Sulfino- | -sulfinsäure | |
| R–COO−M+ R–COO−M+ |
 |
Carbonsäuresalze | Metallcarboxylato- - |
Metall-...-carboxylat Metall-...-oat |
z. B. Acetat |
| R–SO2–O−M+ | Sulfonsäuresalze | Metallsulfonato- | Metall-...-sulfonat | ||
| R–SO–O−M+ |  |
Sulfinsäuresalze | Metallsulfinato- | Metall-...-sulfinat | |
| R–S–O−M+ | Sulfensäuresalze | Metallsulfenato- | Metall-...-sulfenat | ||
Anhydride | |||||
| R1–CO–O–CO–R2 | 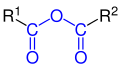 |
Carbonsäureanhydride | - | ...-säure...-säureanhydrid bei gleichen Säuren: ...-säureanhydrid |
z. B. Essigsäureanhydrid |
Ester | |||||
| R1–CO–O–R2 | Carbonsäureester | (R yl-)oxycarbonyl |
(R yl-)...-carboxylat (R yl-)...-oat - |
z. B. Ethylacetat | |
| R1–CO–S–R2 |  |
Thiolester | R1oyl-thio- | S-R2yl-R1-thioat | |
| R1–SO2–O–R2 | Sulfonsäureester | (R yl-)oxysulfonyl- | (R yl-)...-sulfonat | ||
| R–O–NO2 | Salpetersäureester | -nitrat | z. B. Nitroglycerin, Nitrocellulose | ||
Säurehalogenide und -pseudohalogenide | |||||
| R–CO–X R–CO–X |
 |
Carbonsäurehalogenide | Halogencarbonyl- - |
-carbonylhalogenid -oylhalogenid |
z. B. Benzoylchlorid |
| R–SO2–X | Sulfonsäurehalogenide | Halogensulfonyl- | -sulfonylhalogenid | ||
Amide | |||||
| R–CO–NH2 R–CO–NH2 |
 |
Carbonsäureamide | Carbamoyl- #-amino-#-oxo- |
-carboxamid -amid |
|
| R–SO2–NH2 |  |
Sulfonsäureamide | Sulfamoyl- | -sulfonamid | |
Hydrazide | |||||
| R–CO–NH–NH2 R–CO–NH–NH2 |
 |
Carbonsäurehydrazide | Hydrazinocarbonyl- | -carbohydrazid -ohydrazid |
|
Imide | |||||
| R1–CO–NR2–CO–R3 |  |
Imide | |||
Nitrile | |||||
| R–C≡N R–C≡N |
Nitrile | Cyan- - |
-carbonitril -nitril |
z. B. Acetonitril | |
Aldehyde | |||||
| R–CO–H R–CO–H |
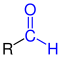 |
Aldehyde | Formyl- Oxo- |
-carbaldehyd -al |
z. B. Formaldehyd, Acetaldehyd |
| R–CS–H R–CS–H |
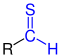 |
Thioaldehyde | Thioformyl- Thioxo- |
-carbothialdehyd -thial |
|
Ketone | |||||
| R1–CO–R2 |  |
Ketone | Oxo- | -on | z. B. Aceton |
| R1–CS–R2 | 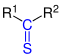 |
Thioketone | Thioxo- | -thion -thioketon |
|
Hydroxy-Verbindungen | |||||
| R1R2–C=N–OH |  |
Oxime | Hydroxyimino- | -aloxim -(carb)aldehydoxim -onoxim |
|
| R–OH | Alkohole und Phenole | Hydroxy- | -ol | Alkohole z. B. Methanol, Ethanol, Isopropanol, Phenol | |
| R–SH | Thiole | Sulfanyl- alt: Mercapto- |
-thiol -mercaptan |
Thioalkohole, Thiophenole z. B. Methylmercaptan | |
Hydroperoxide | |||||
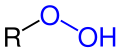
| R–OOH | Hydroperoxide | Hydroperoxy- | -peroxol | ||
| R–O–SH | OS-Thioperoxy- | -OS-thioperoxol | |||
| R–S–OH | Sulfensäuren | SO-Thioperoxy- | -SO-thioperoxol
(früher -sulfensäure) |
||
Amine | |||||
| R–NH2 |  |
Amine | Amino- | -amin | z. B. Anilin, Aminosäuren |
Imine | |||||
| R1R2–C=N–R3 | 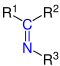 |
Imine | Imino- | -imin | |
| R1R2–C=N–NH2 |  |
Hydrazone | Hydrazono- | -alhydrazon -(carb)aldehydhydrazon -onhydrazon |
|
Funktionelle Gruppen benannt aufgrund der Rangfolge der Atome
Die folgenden funktionellen Gruppen bestimmen den Namen des Stammsystems. Ihre Rangfolge nimmt in dieser Reihenfolge ab: N (ohne oben genannte funktionelle Gruppen) > P > As > Sb > Bi > Si > Ge > Sn > Pb > B > Al > Ga > In > Tl > O (ohne oben genannte funktionelle Gruppen, Peroxide und Ether) > S (ohne Sulfide und Disulfide) > Se > Te > Halogenverbindungen mit mehr als zwei Atomen in der Kette > C > Ether, Sulfide, Sulfoxide, Sulfone > Peroxide > Halogenverbindungen mit einzelnen Halogenatomen.[4]
| Halbstrukturformel | Strukturformel | Stoffklasse | Stammsystem | Beispiele |
|---|---|---|---|---|
| R–NH–NH2 | Hydrazine | Hydrazin | Methylhydrazin | |
| R1–NN–R2 |  |
Azoverbindungen | Diazen | Diphenyldiazen (Azobenzol) |
| R–C=C–R | Doppelbindung | Alkene | Ethen | Ethen, Buta-1,3-dien |
| R–C≡C–R | Dreifachbindung | Alkine | Ethin | Ethin |
Nur mit Vorsilben bezeichnete funktionelle Gruppen
Grundsätzlich nur als Vorsilben (Präfixe) werden folgende funktionelle Gruppen verwendet. Sie haben keine Rangfolge, werden jedoch alphabetisch im Namen eingefügt. Die Tabelle ist nicht vollständig.[5]
| Halbstrukturformel | Strukturformel | Stoffklasse | Vorsilbe | Beispiele |
|---|---|---|---|---|
| R–X | Halogenkohlenwasserstoffe | Halogen- | Fluorchlorkohlenwasserstoffe z. B. Frigen, Chloroform | |
| R1–O–R2 | Ether | (R2yl)-oxy-
(R = C1 - C4: ohne -yl) Nach radikofunktioneller Nomenklatur: (R1yl)-(R2yl)-ether |
Ethoxyethan (Diethylether), Dioxan | |
| R1–S–R2 | Thioether | (R2yl)-sulfanyl- (früher -thio-)
Nach radikofunktioneller Nomenklatur: (R1yl)-(R2yl)-sulfid |
Methylsulfanylmethan (Dimethylsulfid) | |
| R1–SO–R2 | 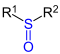 |
Sulfoxide | sulfinyl- | z. B. Dimethylsulfoxid |
| R1–OO–R2 | Peroxide | (R-)dioxy- | ||
| R1R2–CNN | 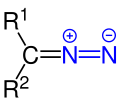 |
Diazoverbindungen | Diazo- | z. B. Diazomethan |
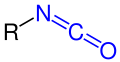
| R–NCO | Isocyanate | Isocyanato- | ||
| R–NCS | Isothiocyanate | Isothiocyanato- | ||
| R–NC | Isocyanide | Isocyan- | ||
| R–NO | Nitrosoverbindungen | Nitrosyl- | ||
| R–NO2 |  |
Nitroverbindungen | Nitro- | Nitrite z. B. Trinitrotoluol (TNT) |
| R–NN+ Z− | Diazoniumsalze | Diazonium- | ||
| R–OCN | Cyanate | Cyanato- | ||
| R–SCN | Thiocyanate | Thiocyanato- |
Alternative Nomenklatursysteme
Neben diesem Nomenklatursystem gibt es noch weitere, weniger gebräuchliche oder veraltete Nomenklatursysteme. Eines davon ist z. B. die radikofunktionelle Nomenklatur, nach der z. B. Chlormethan als Methylchlorid oder Ethanol als Ethylalkohol bezeichnet werden.
Siehe auch
Literatur
- Günter Baars, Roland Franik, Walter Jansen, Hans Pickel, Georg Schwedt, Herbert Sommerfeld: Handbuch der experimentellen Chemie: Sekundarbereich II. Band 10: Funktionelle Gruppen, Fette, Farbstoffe. (Herausgeber: Walter Jansen, Rudolf G Weissenhorn, Wolfgang Glöckner), Aulis, Hallbergmoos 2008, ISBN 978-3-7614-2388-2.
- Dieter Hellwinkel: Die systematische Nomenklatur der organischen Chemie: Eine Gebrauchsanweisung. 4. Auflage. Springer, Berlin 1998, ISBN 3-540-63221-2.
Weblinks
- Offizielle Seite der International Union of Pure and Applied Chemistry (englisch)
- IUPAC-Regeln zur Nomenklatur in der organischen Chemie (Blue Book) (englisch)
Einzelnachweise
- ↑ Eintrag zu functional group. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.F02555.
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry , Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-33 (englisch, qmul.ac.uk [abgerufen am 18. April 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry , Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-35 (englisch, qmul.ac.uk [abgerufen am 18. Dezember 2024]).
- ↑ a b Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry , Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-41 (englisch, qmul.ac.uk [abgerufen am 11. Januar 2025]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry , Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-59 (englisch, qmul.ac.uk [abgerufen am 14. Januar 2025]).